新闻中心
干细胞临床试验汇总
揭示皮肤衰老的关键机制及干预方法

概述
-皮肤衰老不仅受遗传和时间的影响,还受外在(环境)因素的影响。
-报告了与衰老相关的皮肤变化的可能机制和潜在目标。
-总结了皮肤老化研究的最新进展和未来发展方向。
-为新的实用抗皮肤衰老策略提供了理论依据。
摘要
对皮肤衰老机制认识的进步,包括外源性和内源性衰老过程,促进了主要针对改善外观的创新治疗方法的发展。这些发现为开发旨在实现长期、非治疗依赖性的临床益处(包括逆转衰老和减轻相关健康状况)的新型治疗策略提供了潜力。实现这一目标需要进一步研究,以确立针对色素沉着、皱纹和胶原蛋白流失等与衰老相关的皮肤变化的治疗措施的安全性和有效性。需要进行系统研究,以确定最有效的干预措施,并制定最佳的抗衰老治疗策略。这些综述强调了皮肤衰老的特征和可能机制,以及皮肤衰老研究的最新进展和未来方向,为新实用的抗皮肤衰老策略提供了理论基础。
关键词:皮肤,衰老,机制,治疗方法。
01引言
作为人体与外界环境直接接触的器官(总面积约为1.8平方米),皮肤是抵御各种外部病原体和环境损伤的有效屏障[1,2]。皮肤健康是公众普遍关注的问题,促使许多人投入大量资源以追求最佳的皮肤外观[3,4]。衰老会导致人体皮肤发生一系列渐进性变化,包括水分减少、真皮层变薄、色素沉着、弹性下降以及皱纹的产生。这些现象是内在(遗传、时间)[5,6]和外在(环境)衰老因素相互作用的结果,其中外在因素包括紫外线辐射、污染和烟草烟雾[7-9]。21世纪的主要任务之一是抗击人体衰老,尤其是皮肤衰老,这一点正变得越来越明显。皮肤衰老可通过传播衰老相关分泌表型(SASP)来促进全身衰老,可能对其他组织和器官产生影响[10]。此外,与皮肤衰老相关的生理和美学变化可能会影响个人的自尊心和生活质量[11-13]。阐明抗衰老过程的潜在机制对于开发有效干预措施以减轻与年龄相关的皮肤变化至关重要。这一知识对于推动皮肤学级护妆品领域的研究与开发具有重大意义。在本综述中,我们将主要讨论皮肤衰老的特征和可能机制,为新实用的抗皮肤衰老策略提供理论基础。
02皮肤衰老
2.1. 皮肤衰老的定义
在复杂动物中,稳定的细胞命运对于维持组织和生物体的完整性至关重要。然而,这种稳定性是以降低细胞可塑性为代价的,从而限制了再生能力[14,15]。动物体细胞在个体生命历程中面临着相互矛盾的需求。一方面,细胞命运的稳定性需要维持结构完整性并预防恶性肿瘤[16];另一方面,稳定分化的细胞又阻碍了再生。当再生功能持续下降时,身体的组织和细胞会受到损伤,这可能导致衰老和疾病[17,18]。
衰老被定义为一种随时间不断变化的、可重复的功能性过程,与所有高等生物发病率和死亡率的增加相关。随着年龄的增长,人类皮肤不断受到内部和外部刺激的影响,这些刺激会影响其功能,如再生速度减慢,并最终侵蚀皮肤的结构和功能[19-21],主要表现在与保护作用相关的损伤上,如伤口愈合和屏障功能受损、炎症增加、水-热稳态紊乱以及对包括癌症在内的各种皮肤疾病的易感性增加[22-24]。
2.2. 衰老的特征标志
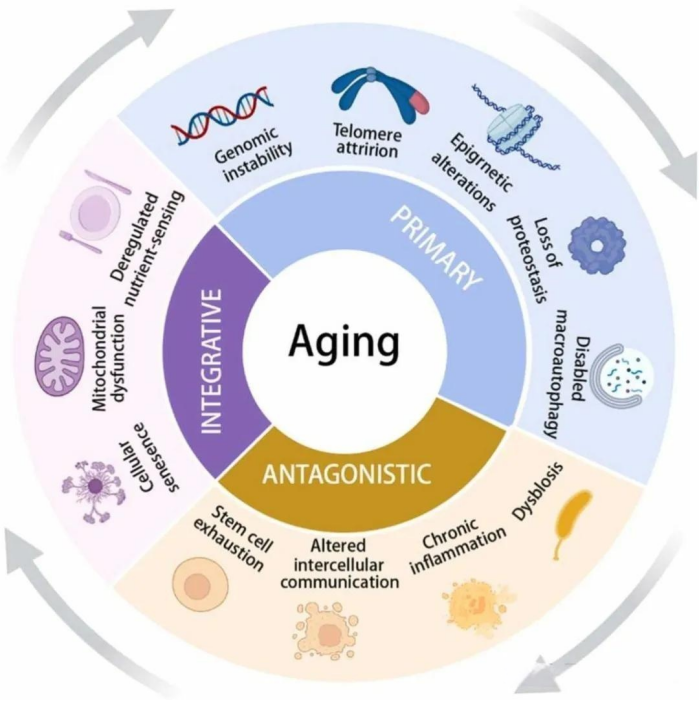
过去三十年来,衰老研究领域取得了显著进展,加深了对衰老过程基本机制的理解[25]。2023年,研究人员首次在《细胞》杂志上发表了十二个衰老的特征标志(见表1和图1)[26]。这些“特征标志”之间的差异本质上是分散的,但它们并非相互独立,因为它们可以相互作用。这种相互依赖性意味着,在实验中增强或减弱某一个特定特征标志时,往往也会影响其他特征标志[26-29]。
表1.衰老的特征

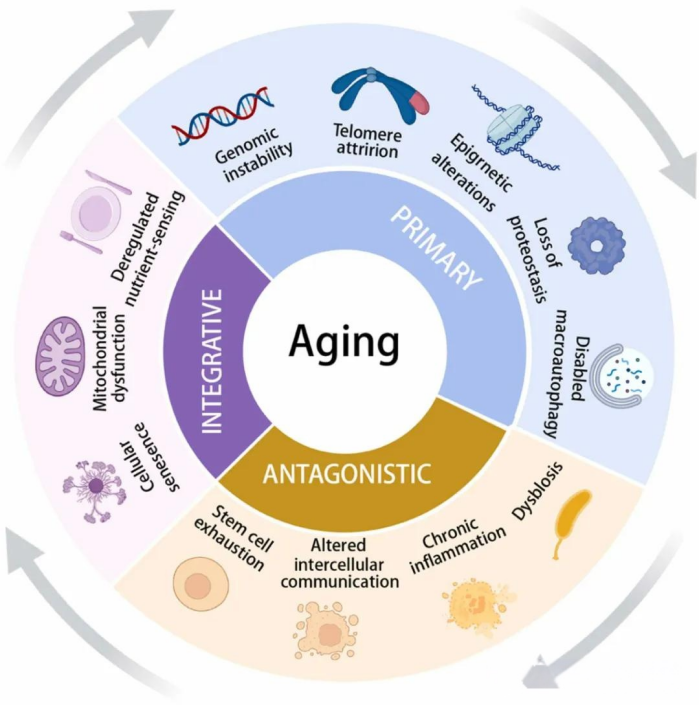
图1. 衰老的标志。这十二个标志被分为五大主要特征:基因组不稳定性、端粒磨损、表观遗传改变、蛋白质稳态失衡、巨噬细胞自噬功能受损;三个对抗性特征:营养感应失调、线粒体功能障碍和细胞衰老;还有四个综合性特征:干细胞耗竭、细胞间通讯改变、慢性炎症和菌群失调。
2.3. 衰老的衰老相关分泌表型(SASP)
衰老的特征是系统性慢性炎症,伴随着细胞衰老、免疫衰老、器官功能衰退和与年龄相关的疾病[67,68]。衰老细胞分泌一系列复杂的因子,这些因子统称为衰老相关分泌表型(SASP)[69-72]。这些因子可促进慢性炎症,并可能诱导邻近细胞发生衰老。SASP是一种现象,即衰老细胞分泌多种因子,这些因子可通过自分泌信号进一步增强[73,74],同时也可通过远距离旁分泌扩散到邻近细胞和组织中[75,76],从而加剧衰老或其他疾病。这些因子包括细胞因子、趋化因子、生长因子、细胞外因子基质蛋白和蛋白酶(表2)[77-79]。研究表明,在正常状态和衰老状态之间,这些因子的变化显著,其中向上箭头表示衰老过程中分泌增加[80]。
表2.衰老相关的分泌表型(SASP)

BLC,B淋巴细胞趋化因子;COX,环氧合酶;DPP4,二肽基肽酶;ECM,细胞外基质;EGF,内皮生长因子;ET-1,内皮素;FGF2,成纤维细胞生长因子2;G-CSF,粒细胞集落刺激因子;GM-CSF,粒细胞-巨噬细胞集落刺激因子;GRO,生长相关癌基因;HGF,肝细胞生长因子;ICAM,细胞间粘附分子;IL,白介素;IP,γ干扰素诱导蛋白;MCP,膜辅助蛋白;M-CSF,巨噬细胞集落刺激因子;MMP,基质金属蛋白酶;OPG,骨保护素;P53,肿瘤抑制基因;PAI,纤溶酶原激活物抑制剂;PDGF,血小板衍生生长因子;PGE2,前列腺素E2;ROS,活性氧;RXR,维甲酸X受体;SEMA3F,信号蛋白-3F;SPARC,富含半胱氨酸的酸性分泌蛋白;sTNFR,可溶性肿瘤坏死因子受体;TGF-β,转化生长因子-β;TIMP-2,金属蛋白酶组织抑制剂-2;TRAIL,肿瘤坏死因子相关凋亡诱导配体;VEGF,血管内皮生长因子。
03衰老对皮肤的影响:潜在机制和目标
皮肤由三层组成,即表皮、真皮和皮下组织(图2)。表皮是最外层,是一种具有永久增殖和更新能力的分层上皮,具有防止病原体浸润和调节体内水分流失的保护功能。这一层包含许多不同类型的细胞,包括角质形成细胞、机械感受性默克尔细胞、抗原呈递的朗格汉斯细胞和黑素细胞[94,95]。
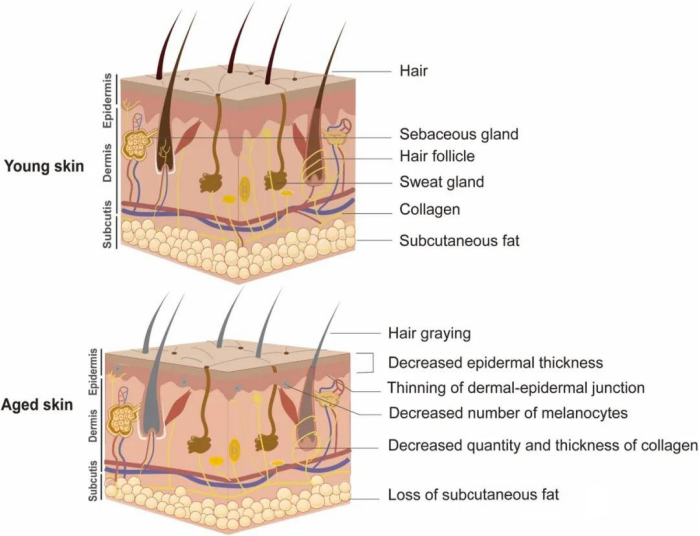
图2. 年轻皮肤与衰老皮肤的对比图。皮肤会随着时间的推移而老化(个体老化、遗传老化),同时也会受到环境因素的影响(外源性老化)。衰老的皮肤通常表现为萎缩和变薄。真皮表皮交界处(DEJ)变得平坦,皮肤出现皱纹和松弛等老化迹象。由于黑色素细胞功能异常,头发和皮肤会出现色素沉着异常。
表皮中的黑素是在黑素细胞的黑素体中产生的,在光保护中起着关键作用[96,97],决定了人类皮肤的颜色。黑素合成主要受α-黑素细胞刺激素(MSH-α)和促肾上腺皮质激素(ACTH)的调节,它们来源于前阿黑皮素(POMC)的裂解,激活黑素受体(黑皮质素受体1)MC1-R,并刺激黑素产生活性[98]。
真皮主要由真皮驻留细胞与细胞外基质复杂网络的动态相互作用维持,为皮肤提供机械强度和弹性回缩。真皮的驻留细胞成分包括成纤维细胞、真皮树突状细胞和肥大细胞[99-101]。细胞外基质包含两种主要的蛋白纤维,即胶原和弹性蛋白。除了胶原纤维外,糖胺聚糖(GAG)和蛋白聚糖(PG)也是细胞外基质中丰富的结构成分[102,103]。PG和GAG呈无定形状态,包围并嵌入真皮中的纤维和细胞基质元素。GAG链含有大量带负电荷的羧基和硫酸基团,可能在维持组织水分含量方面发挥重要作用[103]。尽管它们仅占真皮干重的0.2%,但它们能吸收相当于自身体积1000倍的水分,对调节真皮的保水性和压缩性起作用。皮下脂肪组织通常不被视为皮肤的一部分。然而,它在体温调节和能量储存方面具有重要功能,并提供缓冲和皮肤稳定性[104]。
由内在衰老和外在衰老引起的皮肤变化是不同的(表3,图2)。内在衰老按时间顺序发生,导致细胞损伤的积累。其表现特征包括表皮变薄、细纹出现、弹性丧失、色素沉着异常、干燥和白发等可见迹象。表皮变薄是内在皮肤衰老最显著的变化[5]。厚度的丧失可能是真皮与表皮之间距离减小导致的,这会导致表皮营养供应不足和基底细胞增殖减少[105]。细胞外基质网络的退化导致皮肤弹性下降、可塑性降低和松弛增加[106,107]。
表3.内外源性衰老对皮肤的影响及后果

胶原和纤维蛋白是细胞外基质网络的主要成分,蛋白质含量的丧失与基质金属蛋白酶(MMPs)密切相关[108-111]。MMPs是一种普遍存在的内肽酶家族[112]。MMP的表达和转化生长因子-β(TGF-β)信号的抑制导致细胞外基质(ECM)蛋白的裂解或降解(图3)。MMP-1是导致人皮肤中I型和III型胶原纤维断裂的主要蛋白酶。被MMP-1切割后,胶原可进一步被MMP-3和MMP-9降解[112]。这阻碍了成纤维细胞与ECM之间的机械相互作用,从而减小了真皮成纤维细胞的尺寸。衰老的成纤维细胞产生更多的活性氧(ROS),这进一步增加了MMPs的表达并抑制了TGF-β信号,形成了一个加速皮肤衰老的正反馈循环[113-115](图3)。此外,与年龄相关的皮下脂肪丧失也可能导致衰老皮肤的皱纹和松弛[116]。
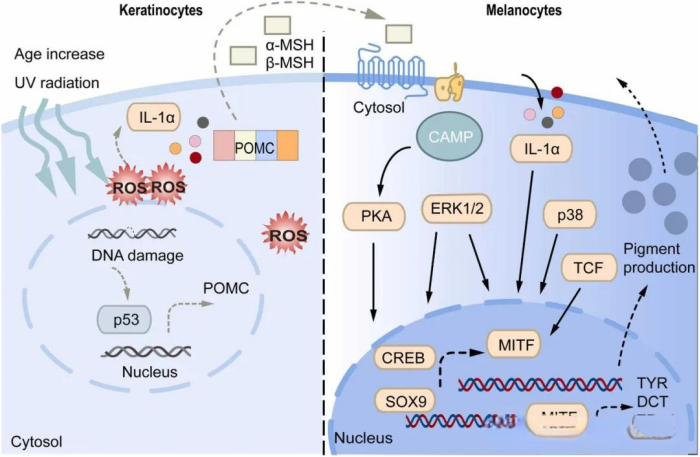
图3. 胶原和弹性蛋白变化的示意图。CREB,cAMP反应元件结合蛋白;DCT,多巴色素互变异构酶;ERK 1/2,细胞外调节蛋白激酶;MITF,小眼相关转录因子;PKA,蛋白激酶A;POMC,阿黑皮素原;SOX9,性别决定区Y盒蛋白9;TCF,转录因子;TYR,酪氨酸酶;TRP1,酪氨酸酶相关蛋白1。
外源性老化表现为皮肤粗糙、深皱纹、色素沉着、松弛、毛细血管扩张以及癌前病变和恶性肿瘤[117]。厚度的增加主要体现在角质层,因为角质形成细胞的桥粒无法有效降解[118,119]。在年轻皮肤中,弹性蛋白和胶原纤维紧密排列且高度有序,但在外源性皮肤老化过程中,成纤维细胞和巨噬细胞分泌的基质金属蛋白酶-12(MMP-12)会导致功能性弹性纤维减少,从而导致皮肤松弛[108,120]。异常色素沉着是皮肤老化的常见症状(图4)[121,122]。紫外线可促进黑素细胞的增殖和募集,增加树突的数量,并促进黑素小体向角质形成细胞的转移[123]。外源性老化的皮肤处于干燥状态,这通常被认为与糖胺聚糖(GAG)有关。虽然皮肤中GAG和蛋白聚糖(PG)的表达和调控机制尚不完全清楚,但这并不影响这些分子作为皮肤老化重要因素的事实。
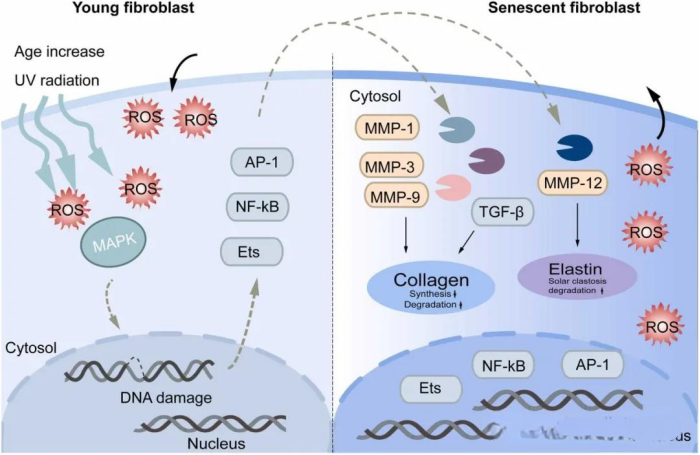
图4. 与色素沉着变化相关的信号串扰示意图。AP-1,激活蛋白-1;Ets,E-二十六(E-twenty-six,一种转录因子家族)。
04皮肤老化的疾病干预
4.1. 当前针对皮肤老化的干预策略旨在针对或减轻老化过程的干预措施,通常被称为抗衰老疗法,包括一系列用于延缓或可能逆转与年龄相关的生理衰退的策略。2019年,全球健康研究所(全球健康研究院)发布了全球健康经济统计数据,确认在健康支出方面最活跃的相关领域是“个人护理、美容和抗衰老”产品。2018年至2021年间,抗衰老市场以约8%的速度增长,预计到2024年将达到2710亿美元[133]。抗衰老策略的开发有着明确的目标,即实现年轻和健康的皮肤。本文简要回顾了广泛使用的抗衰老方法及其分子机制(表4)。
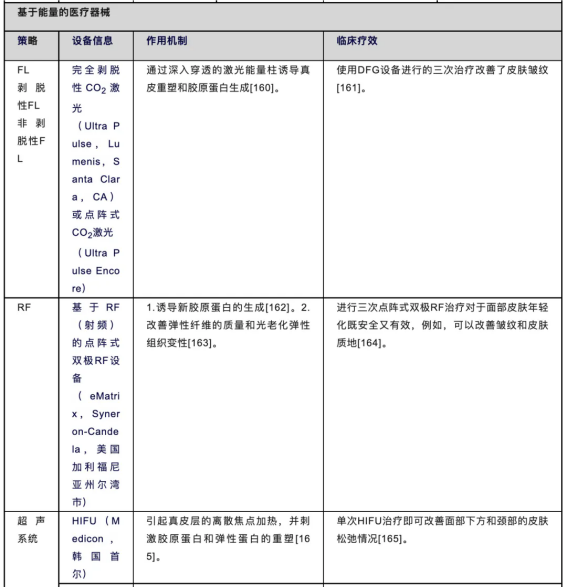
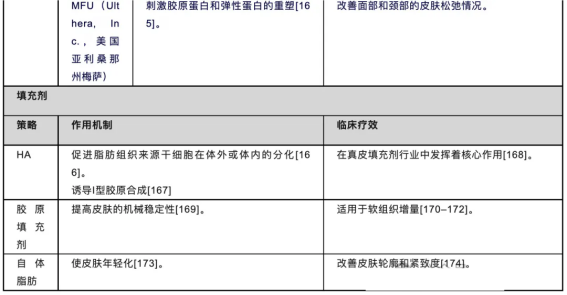
表4.代表性抗衰老方法的作用机制与临床疗效

维A酸(RA)仍然是抗衰老产品中被批准的治疗药物[175]。维A酸是由维生素A、其衍生物以及通过相同途径作用的合成分子组成的化合物家族[136]。术语“视黄醇”包括视黄醇本身及其各种酯类。它们通过维A酸受体(RARs)和维A酸X受体(RXRs)发挥作用,增加I型前胶原的数量并减少基质金属蛋白酶(MMPs)的数量[176]。维A酸可以增加真皮中I、III和VII型胶原蛋白的含量,并将真皮中的胶原蛋白重新组装成新的编织束。此外,维A酸还能刺激真皮中弹性组织和糖胺聚糖(GAG)沉积的正常化[138,139]。在临床试验中,局部使用维A酸对皮肤老化的治疗具有临床效果,包括皱纹、粗糙和松弛。然而,它们可能会刺激相当一部分人群,因此有必要进一步开发降低其刺激潜力的方法[177]。
数十年来,抗坏血酸(维生素C)已被广泛用作抗衰老和色素沉着的外用药物。抗坏血酸可以消除其氧化为单脱氢抗坏血酸时产生的大部分活性氧(ROS),然后进一步氧化为脱氢抗坏血酸,能够维持人体皮肤的正常生理状态。含有抗坏血酸的局部制剂在抗衰老方面具有临床效果。在皮肤中,抗坏血酸是前胶原和弹性蛋白合成所必需的辅因子[146,179]。体内外研究表明,抗坏血酸可诱导人皮肤成纤维细胞合成胶原,并增加真皮的厚度。然而,抗坏血酸的皮肤渗透性差和化学不稳定性会降低其临床疗效,这有待进一步研究。局部用α-羟基酸在治疗光老化皮肤方面也显示出临床疗效[180,181]。5%~25%浓度的乙醇酸或乳酸可刺激真皮中糖胺聚糖(GAG)和胶原的产生,并改善弹性纤维的组织学质量[182]。
肽是由短氨基酸链组成的,由于其分子量小,可以穿透角质层。它们作为信号分子,影响各种细胞过程,包括成纤维细胞的调节和细胞外基质(ECM)成分的合成[155,156]。多肽可以增加成纤维细胞中胶原的产生,并减少胶原酶对现有胶原的分解,从而可能改善自然老化和光老化皮肤中细纹和深纹的临床表现[183]。2011年,含有肽的抗衰老化妆品占市场价值的23.5%,到2018年这一比例上升至25.2%(数据来自在葡萄牙药店销售的抗衰老产品的多国制造商)[184,185]。尽管这些产品的效果尚未像大多数受美国食品药品监督管理局(FDA)监管的药物那样经过严格测试,但越来越多的证据支持使用这类产品[186]。有报道称,一些肽与接触性皮炎等不良反应有关,但尚无有力证据支持这一点[187,188]。
激光和光源以及其他能量设备,包括射频、超声和冷冻疗法,用于治疗老化、色差或皮肤不平整[160,189]。激光治疗是一种无毒、无创的治疗方法,通过操控光能促进皮肤细胞的再生和修复[190]。激光技术在医学领域的应用已受到鼓励,如皮肤科、眼科、牙科和一些外科手术[190,191]。激光技术依赖于热载体中获得的热量,使得波长能够深入皮肤且散射较少。传统的激光表面重建可以使面部年轻化并紧致面部轮廓。然而,它往往伴随着延迟愈合、红肿和感染等不良反应。点阵光热解(FP)是传统激光技术改进的结果。FP是一个小的垂直通道,可以使用CO2或Er:YAG激光深入皮肤进行蒸发。其消融的皮肤深度通常比传统消融更深。常用于光老化、皮肤年轻化、黄褐斑和一些色素沉着障碍等适应症[192]。此外,二氧化碳点阵激光(FL-CO2)治疗是一种最近引入的连续消融表面重塑方法,该设备消融激光的主要图像会引起胶原加热和皮肤重塑,但不会发生表皮损伤和组织蒸发,从而提高了使用的安全性[193,194]。
在过去的十年中,射频(RF)设备已成为美容皮肤科中一种常见且非侵入性的技术,通过促进胶原蛋白和弹性蛋白的产生来改善皮肤松弛状况[195]。尽管这种治疗不能替代外科手术,但对于需要最短恢复时间的忙碌患者而言,它是一种被称为“午休美容”的理想选择。相关研究显示,患者对于这种治疗的满意度非常高[195]。接受单次射频设备治疗后,参与者的皱纹显著改善,且未报告任何不良反应[196]。在一项试验中,参与者接受了多次治疗(每周5次,持续4周,随后每周2次,持续7周),45名参与者报告称皮肤弹性和紧致度显著改善,整个治疗过程中无疼痛感,仅出现轻度暂时性红斑作为不良反应[197]。在连续12周对双颊、下腹部和大腿进行高强度聚焦超声(HIFU)治疗后,参与者的皮肤弹性显著改善,且在治疗后4周和12周均未报告疼痛,随访期间也未发现任何严重不良反应。由此可见,在医生的合理建议和指导下使用当前医疗设备,其安全性仍然相对较高[198]。研究表明,使用剥脱性点阵光热解(AFP)设备进行两到三次治疗可以改善面部皮肤的光老化现象,而使用差频产生(DFG)设备进行三次治疗可以改善皮肤皱纹[161]。
超声被认为是一种安全、有效且非侵入性的技术,可用于改善亚洲人群的面部皱纹和皮肤松弛。聚焦超声(HIFU)可能是这种技术的最佳代表[199]。HIFU技术将目标组织的直接超声可视化与非侵入性聚焦超声能量的传输相结合。通过在特定组织中聚焦高频超声束,以凝固的方式产生瞬时微热损伤,而不损伤表皮和相邻组织,从而选择性地诱导细胞损伤和目标体积减少。进而,通过胶原蛋白的收缩和重塑,使皮肤变得紧致[200-202]。此外,一些研究表明,HIFU技术还可以改善光损伤引起的色素沉着,但对长期色素沉着引起的雀斑或黄褐斑无影响[201]。
用于注射的美容皱纹填充剂已获得美国食品药品监督管理局(FDA)作为医疗器械中的软组织填充剂批准。这些填充剂被注入皮肤以纠正软组织轮廓缺陷,如中度和重度皱纹[203]以及面部脂肪流失的迹象。皮肤填充剂可分为三种主要类型:临时性、半永久性和永久性。前者包括透明质酸填充剂,它们可以提供安全有效的矫正效果,但持续时间有限,通常最长为1-2年[166]。此外,聚左乳酸和羟基磷灰石等永久性填充剂,以及聚甲基丙烯酸甲酯和液态硅树脂等也被用作面部年轻化的注射填充剂。透明质酸(HA)是一种线性糖胺聚糖聚合物,存在于脂肪组织的细胞外基质中。它可以用作支架来促进体内和体外的脂肪干细胞分化[166]。一些研究表明,透明质酸可以增强细胞外基质(ECM)的结构支撑,并恢复老年皮肤中成纤维细胞的能力[167]。此外,HA填充剂还可以通过激活成纤维细胞中的TGF-β信号通路来诱导I型胶原蛋白合成并增加成纤维细胞增殖[167]。
胶原蛋白是一种天然蛋白质,是皮肤和身体其他结缔组织细胞外基质的主要成分。胶原蛋白的纤维结构由于其三螺旋蛋白质结构作为皮肤的支撑结构,是不可或缺的机械稳定性来源。由于衰老和其他因素导致的天然胶原蛋白流失会导致内部和光老化皮肤变薄和萎缩。1981年,牛胶原蛋白(Zyplast)成为美国首个获批用于美容的面部填充剂。所有可注射胶原蛋白产品均由利多卡因(约0.3%)和35毫克/毫升(最高可达65毫克/毫升)的胶原蛋白磷酸盐缓冲液组成[204]。目前,可注射胶原蛋白填充剂仍用于软组织增强。
将患者自身多余脂肪区域的脂肪移植到其他皮肤缺陷处是最古老的软组织增强方法。脂肪注射填充剂因其多种优点而得到广泛接受[174]。自然而言,患者的细胞不太可能引起敏感性或炎症反应,因此被认为具有极高的生物相容性。然而,这一过程更具侵入性,耗时较长,需要临床医生进行准备和操作,患者也需要恢复时间,并且费用更高。最佳疗效和最小副作用主要取决于合格皮肤外科医生的专业技能。
4.2. 抗衰老的潜在策略干预
靶向衰老细胞已成为一种抗衰老的替代疗法。目前,这可以通过特异性消除衰老细胞和调节其分泌表型来实现[205]。靶向senolytics(选择性消除衰老细胞的药物)对衰老细胞的主要理由是它们对凋亡具有固有抗性(图5)。这一特性使它们成为有害因素,因此有必要开发能够特异性促进其清除的策略[205]。用Bcl-2蛋白家族抑制剂ABT-737处理的K5-p14ARF小鼠[206]可以有效地从表皮中消除衰老细胞,从而促进毛囊干细胞的增殖[207]。FOXO4-DRI是一种迫使p53核排斥的肽,它通过在核小体中螯合p53来防止其诱导凋亡,从而保护衰老细胞的存活能力。FOXO4-DRI恢复了p53的凋亡作用,并改善了衰老相关组织稳态失衡的后果[208]。其他研究人员对9名糖尿病肾病患者进行了达沙替尼和槲皮素的短期系统干预,发现该组合可以减少衰老细胞的频率(以p16INK4a和p21CIPI阳性细胞为评估标准),但未报告皮肤质量的变化[209]。
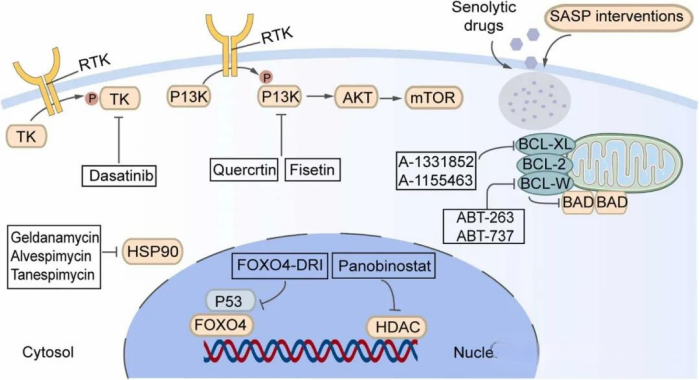
图5. 皮肤衰老疾病干预示意图。AKT,蛋白激酶B;FOXO4,叉头框蛋白O4;P13K(应为PI3K),磷脂酰肌醇-3-激酶;HDAC,组蛋白去乙酰化酶;HSP90,热休克蛋白90。
这些药物本身往往具有毒性,这可能限制了它们在人类身上的应用。此外,它们通过复杂的细胞和非细胞自主效应促进疾病的发生和发展,因此其消除可能会产生不可预测的不良影响[210,211]。因此,抑制衰老相关分泌表型(SASP)可能是一种更安全的方法。以下是一些潜在的抗衰老策略。
4.2.1. 生活方式干预
科学的生活方式是保持健康、延缓甚至逆转衰老的最有效途径[212,213]。美国营养协会的研究团队对受试者的饮食、运动及睡眠进行了干预,八周后,受试者的生物年龄平均年轻了4.6岁[214]。
虽然该研究未直接展示皮肤状态的变化,但皮肤衰老作为衰老的一种表现,也应被纳入生物年龄的考量之中。其他研究表明,运动可通过调节IL-15来调节皮肤代谢和衰老[215,216]。防晒和良好的护肤习惯也是延缓皮肤衰老的有效策略[217,218]。此外,目前尚无证据表明热量限制可以延缓皮肤衰老[219]。
4.2.2. 植物成分
天然化合物因其含有多种天然抗氧化剂,能够保护和维持皮肤的物理和代谢完整性,长期以来一直被用作护肤品成分以减缓皮肤衰老过程[220]。2015年至2019年间,全球“天然化妆品”市场持续扩张,年均增长率达到10-11%。这一市场也为化妆品行业提供了巨大的机遇[221]。
在化妆品的植物制剂中,多酚因其抗氧化、自由基清除、抗肿瘤、抗炎、抗血栓、抗菌等生物活性而越来越受到关注。研究发现,包括黄酮类在内的多酚[222,223]在局部使用时,可通过抑制透明质酸酶、基质金属蛋白酶胶原酶和丝氨酸弹性蛋白酶等皮肤酶的基因表达和活性,使皮肤年轻化[224](见表5)。
表5.植物提取物在皮肤衰老背景下的作用机制。
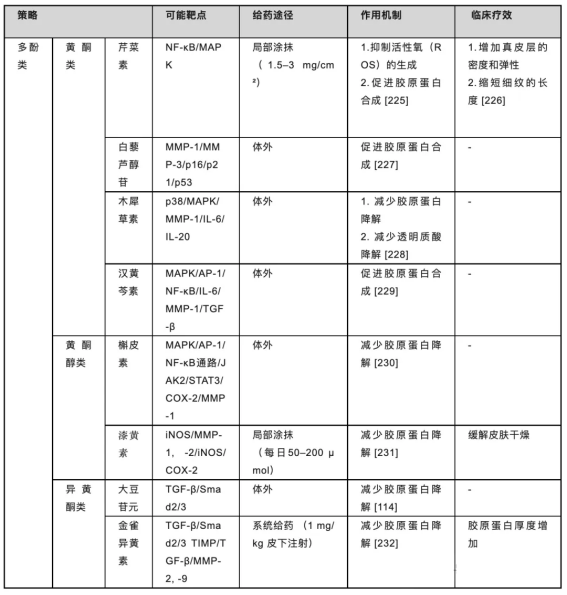
然而,据我们所知,目前关于植物成分的功效和机制的证据很少,且往往缺乏相关性。此外,从种植到提取方法,影响植物制剂组成的因素众多,也具有很大的复杂性。
4.2.3. 海洋生物
海洋生物技术的进步推动了人们对抗衰老化妆品配方中海洋来源成分潜在利用的日益关注。对葡萄牙市场上商业可用的抗衰老配方产品的分析显示,海洋来源成分的使用量有所增加。2011年,在所分析的产品中,只有6%(n=190)含有这些成分,而到了2018年,这一比例上升到了33%(n=103)[233]。在海洋生物多样性中,细菌和藻类是活性成分的主要来源[234]。据报道,包括浮游生物、海绵、鱼类、甲壳类动物(如卤虫)、海葵、海星、囊泡、软珊瑚等在内的海洋生物,通过抗氧化、保湿和抗衰老作用,具有护肤效果[234]。尽管市场上已经出现了一些海洋产品,但与广阔的海洋和未来的发现相比,这些产品的数量仍然很少。关于它们的大多数知识仍然有限,而且由于海洋生物生物量的减少和大规模生产/养殖的难度,这种高潜力在2011年和2018年并未转化为商业抗衰老化妆品配方的数量[235,236]。此外,为了确保海洋成分在化妆品应用中的有效性和安全性,还需要进一步推动和扩大抗衰老的可能性[237]。
4.2.4. 干细胞疗法
干细胞在维持组织稳态中发挥着至关重要的作用,然而,其功能随年龄增长而发生的改变以及对器官衰老的后续影响尚不完全清楚[238-241]。有研究表明,应激诱导的遗传毒性损伤和氧化应激会导致皮肤干细胞中胶原蛋白XVII(COL17A1)表达的波动。COL17A1水平的这些变化会促进干细胞微环境中的细胞竞争[242,243]。当干细胞具有高水平的COL17A1(对称分裂)时,它们表现更好,并排挤出具有低水平COL17A1(非对称分裂)的邻近应激细胞。具有较高能力的干细胞被选择来维持皮肤的平衡,但随着时间推移,它们会失去COL17A1,导致竞争能力下降,从而引发衰老。这种衰弱会导致附近的细胞(如黑素细胞和成纤维细胞)减少,进而促进皮肤衰老。然而,如果我们能够维持COL17A1的水平,可能有助于预防皮肤衰老,为开发抗衰老治疗方法提供潜在途径[244,245]。
4.2.5. 外泌体疗法
外泌体是细胞衍生的纳米级囊泡,携带包括蛋白质、核酸和脂质在内的多种生物分子,能够与邻近或远距离的细胞进行通信[246,247]。近期研究表明,内源性外泌体在皮肤的生理和病理发展中发挥重要的调节作用。研究发现,外源性外泌体能够维持皮肤的稳态和年轻状态(表6)[248-250]。
在HDF球中培养的外泌体(3D-HDF-expos)通过下调TNF-α和上调TGF-β,降低MMP-1的表达,诱导有效的胶原蛋白合成,并在体外和裸鼠光老化模型中改善炎症,从而显示出抗皮肤衰老的特性[251]。在UVB诱导的光老化和自然衰老模型中发现,多能干细胞衍生的外泌体(iPSC-Exos)通过降低衰老相关β-半乳糖苷酶(SA-β-gal)和MMP1/3的表达水平,并恢复老化HDFs中I型胶原的表达,实现了抗衰老效果[252,253]。人脂肪源性干细胞(ADSCs)已成为一种有前景的抗衰老治疗策略。研究表明,ADSC-Exos通过抑制与年龄相关的蛋白质p53、p21和p16的表达水平,增加HDFs中I型胶原的表达,并降低ROS的活性和与年龄相关的SA-β-Gal,从而发挥抗衰老作用[254]。
表6.外泌体在抵抗皮肤衰老中的作用机制
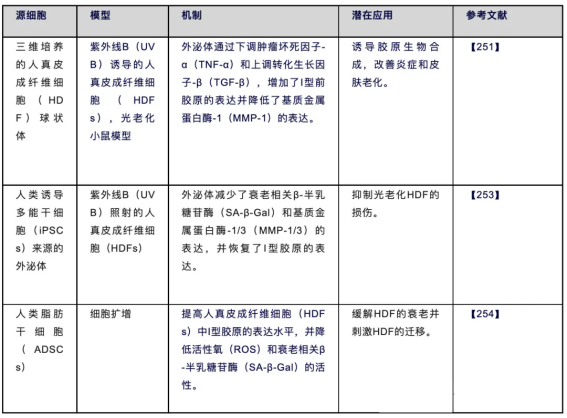
Human Dermal Fibroblasts, HDFs:人真皮成纤维细胞;Senescence-Associated β-galactosidase, SA-β-gal:衰老相关β-半乳糖苷酶;Ultraviolet, UV:紫外线;Three-Dimensional, 3D:三维;Induced Pluripotent Stem Cells, iPSCs:诱导多能干细胞;Transforming Growth Factor Beta, TGF-β:转化生长因子β。
4.2.6. 针灸与艾灸
针灸是一种传统的中医形式。针灸是基于疾病由身体气机紊乱引起的理论而发展出的一种重要的中医治疗方法,已用于治疗多种疾病[255],包括皮肤病。2015年发表的一项系统综述发现,针灸改善了皮炎、黄褐斑、瘙痒症、荨麻疹、多汗症和面部弹性等皮肤症状,未来的研究最好采用双盲和标准化对照干预[255]。
05皮肤衰老治疗中的差距与挑战
经过数十年的研究,学者们已从植物、海洋生物和肽中获得了大量抗衰老活性化合物,并进行了相关实验验证,为植物、海洋生物资源和肽的高价值利用提供了大量依据。然而,由于研究方案的异质性,这些临床前研究结果无法直接转化为临床实践,并且缺乏令人信服的临床研究来证实植物、海洋生物资源和肽在治疗与年龄相关的皮肤变化和损伤中的有效性和安全性。
这要求研究人员进一步研究,以优化和评估植物、海洋生物资源和肽应用的潜在不良影响。首先,临床试验必须得到在适当的细胞和动物模型中获得的可靠临床前结果的支持。例如,在体内衰老研究中,小鼠因其寿命较短、基因组和生理与人类非常相似以及遗传易于操作而成为研究衰老疾病潜在干预和治疗手段的模型[256]。体内研究的模型包括诱导或遗传衰老模型[257]、早衰模型[258,259]、经典长寿动物模型[260]和百岁老人模型[261]。在衰老的体外研究中,根据不同的刺激类别分为:复制性衰老(RS)[262]、癌基因诱导的衰老[263]和化疗诱导的衰老(CIS)[264]。其次,在实验验证之前,需要制定合理的治疗方案和适当的细胞标志物来评估治疗的有效性。最后,应统一研究方案,以便不同研究模型获得的结果具有可比性,并可用于临床实践。
衰老科学正吸引着越来越多的关注者。尽管已经取得了巨大的进步,但衰老机制的许多奥秘仍然未解。因此,需要进行更广泛的研究,以开发针对与年龄相关疾病的新抗衰老策略或产品。
文章链接:
https://doi.org/10.1016/j.cytogfr.2024.07.009




