新闻中心
干细胞临床试验汇总
我国完成国际首例CiPSC诱导胰岛细胞移植治疗糖尿病试验
导语 / Introduction
这可能是属于糖尿病领域的炽热夏季,先有福泰制药公布积极临床数据,后有同种异体(供体)胰岛细胞疗法Lantidra面世。如今,我国科学研究团队宣布全球首例经化学重编程诱导多潜能干细胞(CiPSC)分化的胰岛样细胞移植成功,仅用10天,就实现了胰岛素需要量减半的效果。细胞疗法,正带我们进入一个崭新的糖尿病治疗时代。
1921年的冬天,一种含有大量沉淀物的混浊浅棕色液体在多伦多大学面世,这是世界上第一份可用于人体的纯净胰岛素,无数糖尿病患者的命运就此被改写。
而在100多年后,细胞疗法再次吹响攻克糖尿病的号角,继首个针对1型糖尿病的同种异体(供体)胰岛细胞疗法Lantidra被FDA批准上市后,天津市第一中心医院与北京大学干细胞中心于6日宣布:国际首例化学重编程诱导多潜能干细胞(CiPSC)分化的胰岛样细胞移植手术完成。一名有着11年病史,依赖胰岛素生活的1型糖尿病患者在接受细胞移植后,空腹C肽由移植术前的<0.02ng/ml上升至0.31ng/ml,移植后第10天,每日胰岛素需要量已经降低至移植前的一半!而随着移植的胰岛细胞进一步获得功能成熟,这一数字还有望再度刷新。
糖尿病治疗已逐渐步入“细胞移植时代”,那么这一次,会是治愈的终章吗?
全球首例新iPSC技术治疗糖尿病数据积极
胰岛素是很多糖友们的“救命稻草”,但这项划时代的发现并不是一场完美的医学胜利。
原因是:注射胰岛素只能为患者输送控制血糖的”弹药”,却逆转不了患者体内胰岛β细胞衰竭、死亡的事实,一旦停药,体内胰岛素会再次枯竭,让糖尿病卷土重来。换而言之,胰岛素无法真正治愈糖尿病,它只是将后者转变为一种需要长期与之斗争的慢性疾病。
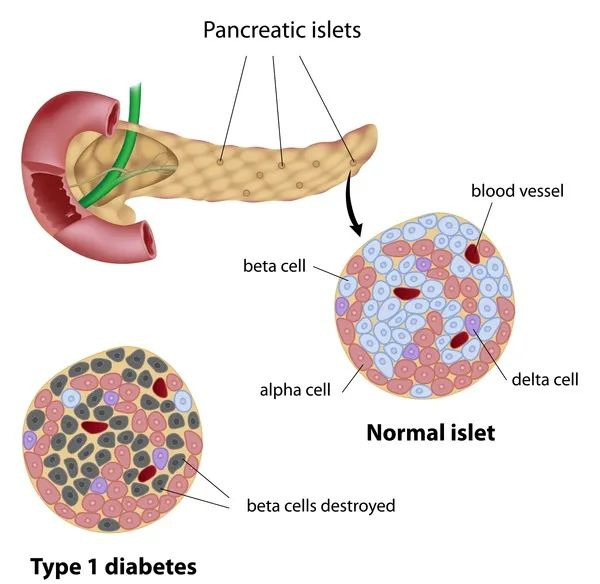
△1型糖尿病发病机制:胰岛β细胞受损,导致胰岛素分泌绝对不足造成
正常人可能想象不到这种漫长斗争中的压力与痛苦——日复一日的扎针,测血糖,望不到尽头的账单—据青少年糖尿病研究基金会2021年发布的数据,1型糖尿病的平均终身治疗成本为每人40万美元。这个数额足以把许多人拦在门外,但更让人接受不了的是:即使有胰岛素控制,也不是所有人都能逃过并发症的厄运。因此,直到今天,治愈糖尿病仍是很多研究者为之奋斗的目标。
北京大学干细胞研究中心主任邓宏魁也是其中一员,经过多年的耕耘,其团队所发明的化学重编程诱导多潜能干细胞CiPSC可高效增殖、分化为结构和功能与人原代胰岛相似的人CiPSC分化胰岛,有望替代糖尿病患者体内衰竭死亡的胰岛β细胞,成为治疗糖尿病的全新方案。
iPSC技术我们都知道,那CiPSC技术又是什么呢?
广义上来说,CiPSC也属于iPSC的一种类型,只是诱导方式不同。它是除体细胞核移植和转录因子表达之外,第三种逆转体细胞发育的方法——使用化学小分子将人成体细胞诱导为多潜能干细胞(人CiPS细胞),这一过程可简称为“化学重编程”。

△邓宏魁在接受央视采访时表示:CiPSC技术为国家在再生医学和干细胞领域突破了一个瓶颈
这一由国内团队自主研发的技术,既不需要使用人卵母细胞,也不需要破坏人的早期胚胎,不但避免了细胞核移植存在的伦理问题、也突破了第二代技术(可能有基因突变的风险),是人多潜能干细胞制备的全新途径。
2022年,邓宏魁研究组进一步将hCiPSC定向诱导分化为胰岛细胞(hCiPSC-islets),随后这些hCiPSC-islets被注射到糖尿病模型猴腹直肌前鞘下,结果所有接受移植的糖尿病猴的血糖控制都得到了显著改善,一只糖尿病猴C肽分泌水平甚至达到了健康水平。
△邓宏魁团队在《Nature Medicine》上发表“人多能干细胞来源胰岛改善非人灵长类动物的糖尿病”
这一研究结果极大地鼓励了邓宏魁与其研究团队,是时候开展人体实验了!今年6月,他们与天津市第一中心医院获得国家干细胞临床研究正式备案。
首位“吃螃蟹的勇者”是一名病史长达11年的1型“糖友”,在接受移植后当天,她就已经可以下床走动,经检测,胰岛细胞存活良好,空腹C肽由移植术前的<0.02ng/ml上升至术后0.31ng/ml。
而到了移植后的第10天,这位患者每日胰岛素需要量已经降低至移植前的一半,但血糖依旧稳定,而随着移植的胰岛细胞在患者体内进一步得到功能成熟,治疗效果也将在移植后数月内逐渐达到稳定状态。
这一研究结果证明着:CiPSC诱导胰岛细胞移植有望成为治疗1型糖尿病的理想方案,同时这项技术可应用于伴有胰岛功能衰竭的2型糖尿病患者。




