新闻中心
干细胞临床试验汇总
《International immunopharmacology》综述--自噬和衰老的“平衡机制“,看干细胞如何治疗肝纤维化
肝纤维化是一种慢性肝病,其特征是细胞外基质(ECM)蛋白积聚,若不加以控制,肝纤维化可能导致肝硬化或肝细胞癌。
肝细胞损伤、炎症反应和细胞凋亡可由各种原因引起,它们都可诱导肝纤维化。目前针对肝纤维化的治疗方法有抗病毒药物和免疫抑制疗法,但它们的疗效有限。
虽然肝脏具有强大的再生能力,但衰老是肝脏再生的一个巨大不利因素。
而间充质干细胞(MSC)可以调节免疫反应,促进肝脏再生,通过调节免疫系统和促进线粒体自噬,维持肝细胞线粒体质量,从而为肝脏提供保护。
此外,间充质干细胞还可以抑制导致疾病发展的肝星状细胞(HSC)的活化,因此间充质干细胞已经成为治疗肝纤维化的一种有效疗法。
自噬是一个重要的细胞自我降解过程,对维持体内平衡,抵御营养、代谢和感染介导的压力至关重要。此外,与衰老相关的自噬损伤,会引起间充质干细胞数量下降、功能减退。
那么,间充质干细胞的抗纤维化特性与自噬和衰老有什么关系呢?
来自成都中医药大学的研究人员及其合作者在《International immunopharmacology》发表了题为“Unlocking the potential of Mesenchymal stem cells in liver Fibrosis: Insights into the impact of autophagy and aging”的综述,总结了间充质干细胞在肝纤维化治疗中自噬和衰老层面的最新进展。

— 论文首页截图 —
— 骨髓间充质干细胞:肝纤维化治疗全能手 —
肝纤维化在本质上是一个伤口愈合的过程,其中包含几个关键事件,如肝星状细胞活化、细胞外基质过度沉积、免疫细胞浸润和肝细胞衰老。
基于骨髓间充质干细胞的治疗在肝脏纤维化治疗中很有前景,因为这类细胞对于上述病理生理学问题都有一定的作用。
首先,间充质干细胞可以减少表达α平滑肌肌动蛋白(αSMA)的活化肝星状细胞的数量,减少细胞外基质沉积,从而发挥抗纤维化作用。
已有实验证明,在小鼠肝脏纤维化模型中,间充质干细胞分泌组显着抑制多种纤维化因子的表达。局部施用间充质干细胞就可以通过减少成纤维细胞活化和胶原沉积来改善肝纤维化。
另外,间充质干细胞分泌的MFGE8是肝星状细胞活化的强抑制剂,也可减少细胞外基质沉积。
已有研究表明,间充质干细胞可以抑制细胞外基质过度沉积、减弱炎症反应和免疫反应,并在肝纤维化过程中促进肝细胞再生。
越来越多的证据表明,间充质干细胞的抗炎症特性也至关重要。间充质干细胞可以通过减少CD4+T细胞的数量,减弱其活化,促进调节性树突状细胞(DC)和Treg细胞的产生,从而减轻肝损伤。
不过,间充质干细胞治疗的有效性依赖于维持适当的自噬水平,而与年龄相关的自噬损伤会导致间充质干细胞数量和功能下降,从而损害自噬水平。
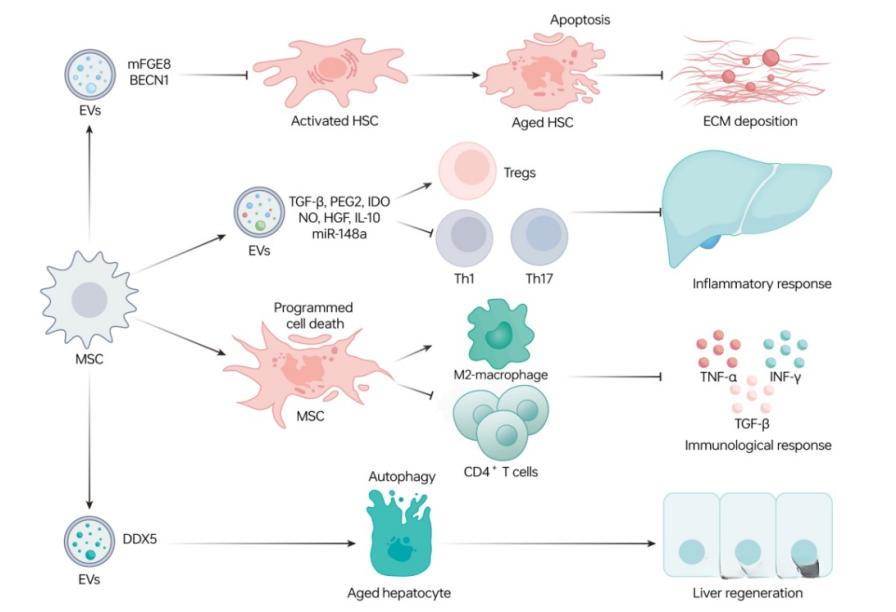
骨髓间充质干细胞在肝纤维化中的潜在机制 来源:Tao, H., et al, 2023
— 自噬:骨髓间充质干细胞的平衡器 —
精确校准的自噬机制控制着间充质干细胞的营养、免疫调节和骨诱导特性。
自噬减少会导致间充质干细胞衰老,自噬过度会缩短间充质干细胞寿命。此外,自噬还在整个衰老过程中保护间充质干细胞库,对于恢复衰老间充质干细胞的特性也有一定的作用。
自噬包含一系列不可或缺的蛋白质,包括Atg5、Atg7、Beclin-1和p62等,它们可以影响间充质干细胞的代谢和功能。因此,自噬对于间充质干细胞发挥治疗作用至关重要。
间充质干细胞的治疗效果依赖于合适的自噬水平,因为良好的自噬水平可以改善扩散过程。在肝纤维化治疗中,操纵间充质干细胞的自噬可能是提高其抗纤维化潜力的一种有效策略。
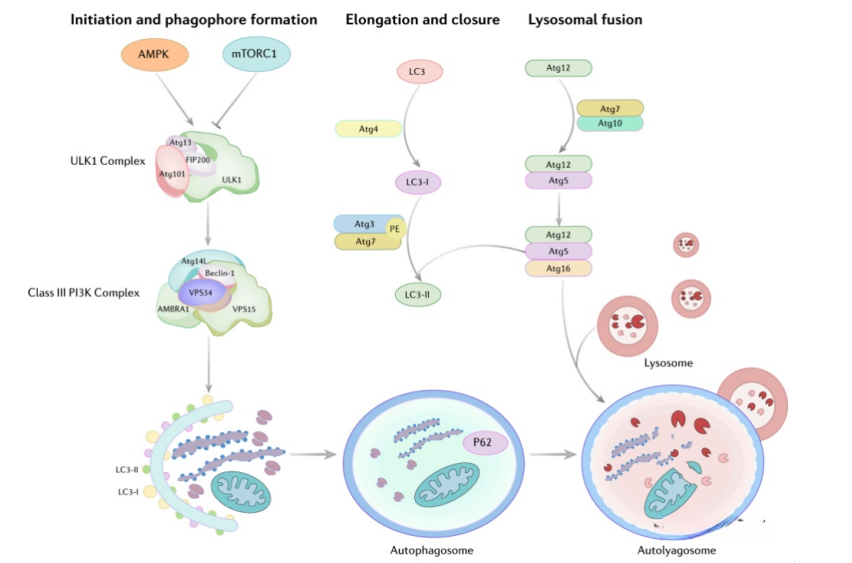
自噬的主要步骤:起始和吞噬细胞形成、延伸和闭合、溶酶体融合 来源:Tao, H., et al, 2023
— 肝纤维化中的自噬与衰老 —
反复和持续的肝损伤会导致肝细胞死亡,引发不可逆的渐进伤口愈合反应,细胞外基质成分异常积累,最终导致严重的纤维化。
自噬可能通过去除受损的细胞外基质蛋白,在预防纤维化中发挥保护作用。
自噬在肝星状细胞分化中也起着至关重要的作用。在小鼠中,抑制肝星状细胞活化和自噬可以减少纤维化反应。
活化的肝星状细胞可以增殖并产生细胞外基质,同时分泌衰老相关分泌表型(SASP),促进细胞外基质降解,并促进其恢复为静止状态。
对于衰老的肝细胞,SASP可以诱导邻近正常肝细胞的衰老,从而进一步激活肝星状细胞。
对于衰老的胆管细胞,SASP可以募集肌纤维母细胞和巨噬细胞来促进肝细胞老化,最终导致肝纤维化。
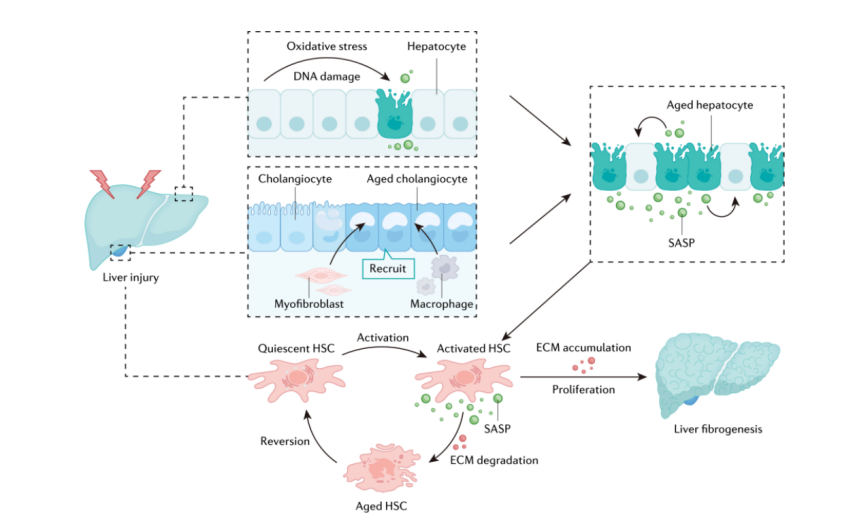
细胞衰老在肝纤维化中的作用 来源:Tao, H., et al, 2023
— 骨髓间充质干细胞的自噬与衰老 —
基础水平的自噬对间充质干细胞维持生物效应器功能至关重要。
在衰老的间充质干细胞中,基础自噬增加,因为它需要维持其自我更新和再生能力。反之,自噬受损和减少,或过度的自噬,都会促进间充质干细胞衰老。
在复制衰老(replicative aging)过程中,MDC(自噬小泡的特异性标记物)和由p53介导的自噬相关效应物Atg12和LC3-I/II在间充质干细胞中均有增加。
肝星状细胞属于肝脏驻留的间充质干细胞。在衰老的肝脏中,肝星状细胞也会衰老,其释放的肝细胞生长因子也随之减少,这对肝脏中的再生反应不利。
衰老的间充质干细胞中,促炎症SASP因子分泌增加,包括IL6、MCP1、IL8、IL1α、Groβ和CCL4。而且,衰老间充质干细胞的免疫调节特性也显著降低。
衰老的骨髓间充质干细胞释放SASP因子,以旁分泌方式将炎症信号传播到邻近的造血干细胞和祖细胞,从而降低其克隆能力,造成更加广泛的衰老影响。
衰老会减少干细胞库,降低再生能力,并损害肝星状细胞功能。总之,衰老和间充质干细胞特性之间存在紧密的联系,衰老会削弱间充质干细胞的修复潜力,并导致组织损伤加速。
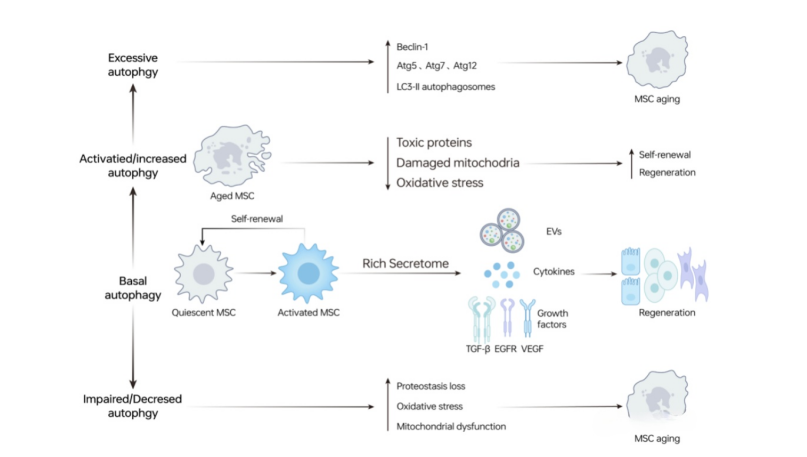
自噬在MSC衰老中的作用 来源:Tao, H., et al, 2023
综上所述,自噬在间充质干细胞衰老中同时扮演着启动子和抑制剂的角色,基础自噬水平有助于维持间充质干细胞特性。
在衰老的间充质干细胞中,自噬增加可以减缓新陈代谢,增强间充质干细胞抵抗衰老的能力。而自噬减少可能导致有毒物质的广泛积累和线粒体受损,加剧炎症反应和细胞损伤,最终加速衰老。
所以,了解自噬与间充质干细胞衰老之间的关系,可以帮助开发新的肝纤维化疗法。
参考资料
[1]. Tao, H., Liu, Q., Zeng, A., & Song, L. (2023). Unlocking the potential of Mesenchymal stem cells in liver Fibrosis: Insights into the impact of autophagy and aging. International immunopharmacology, 121, 110497. https://doi.org/10.1016/j.intimp.2023.110497




